Infoseite
Galactose
Gesundheitsgefahr Galactose?
─ eine wissenschaftliche Analyse von PD. Dr. med. Michael Nehls (8. Juli 2023)
Immer wieder wird in Ratgebern und manchen Büchern Galactose (Schleimzucker) als vermeintlich intelligenter Wunderzucker für geistige Fitness angepriesen; die tägliche Einnahme soll insbesondere gesundheitliche Vorteile bei Alzheimer bieten. Mit solch irreführenden Versprechungen wird viel Schaden angerichtet, aber auch viel Umsatz gemacht. Doch eine einfache Google-Suchanfrage mit der Wortkombination Galactose & Alzheimer & NCBI (National Center for Biotechnology Information, die US-Datenbank für medizinische Veröffentlichungen) liefert seitenweise Publikationen, in denen Galactose dazu verwendet wird, in Tiermodellen Alzheimer zu erzeugen. Das ist genau das Gegenteil einer Schutzwirkung, die in den einschlägigen Ratgebern mit der Einnahme von Galactose versprochen wird. Hier ist dringend Aufklärung erforderlich.
Hippocampale Insulinresistenz
Ausgangspunkt der Alzheimer-Demenz ist das autobiografische Gedächtniszentrum, das anatomisch aufgrund seiner seepferdchenähnlichen Struktur als Hippocampus bezeichnet wird. Im Gegensatz zum restliche Gehirn schützt sich diese evolutionsgeschichtlich sehr alte Hirnregion (Archicortex) vor Blutzuckerschwankungen, indem sie die Zufuhr von Glucose (Trauben- bzw. Blutzucker) durch ein Insulin-abhängiges Transportsystem schützt. Dieser Schutzmechanismus kann durch unsere moderne, artfremde Lebensweise beeinträchtigt werden. Dann entwickelt sich eine hippocampale Insulinresistenz.[1] Infolgedessen kann der Hippocampus so gut wie keinen Zucker mehr aufnehmen, was sich diagnostisch für die Früherkennung der Erkrankung nutzen lässt. Dazu wird ein bildgebendes Verfahren, die sogenannte FDG-PET/CT genutzt. Eine mit einem radioaktiven Fluor-Isotop markierte Glucose (18F-Fluordesoxyglucose, 18F-FDG) wird injiziert und wie „normaler“ Traubenzucker in Körperzellen aufgenommen. Diese Anreicherung in den Organen und Geweben kann mittels Positronen-Emission-Tomografie (PET), kombiniert mit einer Computer-Tomografie (CT) sichtbar gemacht werden.[2] In der Regel ist durch eine FDG-PET/CT schon in einer sehr frühen Phase der Alzheimer-Entwicklung, meist schon Jahre vor den ersten klinischen Alzheimer-Symptomen, in der hippocampalen Region des Gehirns eine verminderte Glucose-Aufnahme zu erkennen. Man spricht von neuronalem oder Typ-3-Diabetes, was jedoch eine fehlerhafte Bezeichnung ist, denn es kommt bei dieser lokalen Insulinresistenz nicht wie beim Typ-1- oder Typ-2-Diabetes mellitus zum begriffsbildenden süßen Urin. Die hippocampale Insulinresistenz ist kein Diabetes mellitus, auch wenn bei Diabetikern ein höheres Risiko besteht, Alzheimer zu entwickeln. (Ein größeres Risiko haben aber auch Menschen mit anderen Zivilisationskrankheiten, da die Krankheitsprozesse oft dieselben Ursachen haben und sich zugleich gegenseitig verstärken.)
Die Ursachen für die hippocampale Insulinresistenz sind vielfältig. Zu ihnen gehören die chronische Entzündung (unter anderem durch sogenannte AGEs, siehe unten)[3], dauerhaft hohe Stresshormonspiegel, Transfettsäuren und nicht zuletzt das sogenannte Alzheimer-Toxin, also das zu Oligomeren verklebende β-Amyloid, wenn es im Überschuss vorhanden ist (als Monomer sorgt es für die Stabilität neuer Erinnerungen). Bei Stress hilft eine gute Stressresistenz. Dafür ist eine produktive adulte hippocampale Neurogenese Voraussetzung, sprich eine lebenslang stattfindende Produktion neuer Nervenzellen im Hippocampus, weil sie unter anderem für eine hohe psychische Resilienz sorgt.[4] Eine produktive adulte hippocampale Neurogenese ist auch der beste Schutz vor Alzheimer bzw. deren Dysfunktion die primäre Ursache für diese hippocampale Demenz, wie ich schon im Jahr 2016 in einer Übersichtsarbeit zeigen konnte.[5] Für den nächtlichen Abbau von β-Amyloid (damit es nicht zu hohen Konzentrationen ansteigt, bei denen es zu den toxischen Oligomeren verklebt) sorgen ein ausreichender Tiefschlaf sowie körperliche Aktivität.[6] Eine reduzierte – oder besser gar keine Zufuhr – von Transfetten und generell eine Ernährung, die keine chronische Entzündung verursacht, schützt ebenfalls vor der Entwicklung einer hippocampalen Insulinresistenz. Mit anderen Worten, es sind durchweg Lebenstil-Faktoren, die auf Dauer eine hippocampale Insulinresistenz und Alzheimer verursachen bzw. uns davor bewahren.
Würde man dem insulinresistenten Hippocampus nur Glucose als Energiequelle anbieten, was bei moderner westlicher Ernährung leider der Normalfall ist, würde dieser regelrecht verhungern, selbst bei hohem Blutzuckerspiegel. Diese mangelhafte Glucose-Aufnahme bei unnatürlicher hippocampaler Insulinresistenz wird nun als Argument benutzt, dem Hippocampus Galactose als alternative Energiequelle zur Verfügung zu stellen, da diese unabhängig von Insulin aufgenommen werden kann. Das scheint auf den ersten Blick eine sinnvolle und logische Lösung zu sein. Doch abgesehen davon, dass die dafür nötige hohe Zufuhr an Galactose ebenso unnatürlich ist wie die Lebensweise, die in der Regel für die hippocampale Insulinresistenz verantwortlich ist, ist diese Vorgehensweise teuer, ineffektiv und höchst ungesund – und dies ganz unabhängig davon, dass es sogar eine wesentlich günstigere, tatsächlich gesunde und natürliche Alternative gibt.
Galactose – Den Teufel mit dem Belzebub austreiben?
Um eine stetige Energieversorgung von Nervenzellen zu gewährleisten ist es wichtig, Energieschwankungen zu vermeiden. Nahezu jeder hat schon einmal erlebt, wie unangenehm es sich anfühlt, wenn der Blutzucker im Keller ist: Der Puls rast, kalter Schweiß bricht aus, man ist blass, unruhig und nervös, zittert, hat weiche Knie und Heißhunger. Diabetiker wissen, dass ein hoher Blutzucker, der das Gehirn anschwellen lässt (der Neocortex nimmt Zucker ungehindert ohne Insulin-Regulation auf), ebenfalls sehr unangenehm ist ─ in beiden Fällen bekommt man Angst, und diese ist nicht unbegründet, denn es droht das Koma. Da unser Gehirn keinen Zucker speichern kann, muss Glucose stetig zugeführt und deshalb der Blutspiegel mittels Insulin in sehr engen Grenzen reguliert werden. Die Galactose umgeht diese Regulation, was im Hinblick auf die hippocampale Insulinresistenz ein Vorteil zu sein scheint. Doch das Gegenteil ist der Fall: Jede Einnahme sorgt für einen nicht regulierten Anstieg und anschließenden Abfall. Es kommt zur hippocampalen Über- und anschließenden Unterzuckerung. Auch wenn es so etwas wie ein hippocampales Koma nicht gibt, ist dies unnatürlich und sicherlich nicht gesund. Nur während der Stillzeit erhalten Säuglinge über die Muttermilch, also auf natürliche Weise, Galactose, jedoch kombiniert mit Glucose in Form von Laktose (Milchzucker). Über die Spaltung mittels des Enzyms Laktase wird die Freisetzung des Galactose-Anteils reguliert. Bei den meisten Kleinkindern weltweit[7] stoppt nach der Stillzeit die Laktase-Produktion, weil es völlig unnatürlich ist, danach weiter Muttermilch bzw. die von Wiederkäuern zu konsumieren. Infolgedessen sind sie für den Rest ihres Lebens Laktose-intolerant und müssen nicht fermentierte Milchprodukte meiden, um eine weitere Laktose-Aufnahme zu verhindern.
Da künstlich zugeführte Galactose nach Aufnahme durch den Darm völlig unreguliert ist, kommt es zunächst im Blut zu einem Galactose-Anstieg (der jedoch bei der Blutzuckermessung übersehen werden würde, da man dabei nur die Glucose misst). Solche Zucker-Peaks sind jedoch höchst ungesund, denn Galactose ist ein reduzierender Zucker, der chemisch mit den freien Aminen der Aminosäuren in Proteinen reagiert. Es bildet sich eine sogenannte Schiff’sche Base, eine Verbindung, die leicht oxidiert und dann sehr stabil ist. Die daraus resultierenden chemischen Verbindungen werden als Advanced Glycation End Products (AGEs), zu deutsch in etwa: fortgeschrittene „Verzuckerungs“-Endprodukte bezeichnet. Man kann sich dies wie eine mit Zucker verklebte Tischoberfläche vorstellen, auf der man ein Süßgetränk verschüttet hat, nur dass sie nicht mehr leicht zu säubern ist. AGEs sind nicht nur Biomarker, sondern zugleich eine wesentliche Ursache für einen beschleunigten Alterungsprozess (ein praktischer Zufall, bedeutet doch das englische Wort to age „altern”). AGEs sind Fremdkörper, die unser Immunsystem entfernen möchte, was aufgrund der atomaren Verklebung nicht leicht ist. Dafür gibt es sogar einen spezifischen Rezeptor, abgekürzt RAGE (zufällig bedeutet im Englischen to rage so viel wie „zornig sein”). Die Aktivierung von RAGE durch AGEs ist tatsächlich eine „zornige“ Reaktion, die über verschiedene Signalwege eine chronische Entzündung verursacht, inklusive der Erzeugung reaktiver Sauerstoffspezies (ROS), was zusammen den Alterungsprozess beschleunigt und somit eine Ursache für die hippocampale Insulin-Resistenz ist (siehe oben).[8]
Galactose in Tiermodellen für beschleunigtes Altern und Alzheimer
So erzeugt Galactose in Tieren eine hippocampale Insulinresistenz, also genau das, was man mit der Empfehlung an Menschen, Galactose einzunehmen, zu überwinden versucht.[9] Galactose hemmt, wie ebenfalls in Tiermodellen gezeigt werden konnte, die adulte hippocampale Neurogenese und sorgt sogar für die hippocampale Neurodegeneration, was einen chronischen Gedächtnisverlust nach sich zieht.[10] Diese Eigenschaft der Galactose wird im Tiermodell auch dazu benutzt, experimentell Alzheimer zu verursachen.[11] Dazu reicht bei Mäusen wie auch bei Ratten eine Menge von täglich 0,1 Gramm (g) pro Kilogramm (kg) Körpergewicht, über nur wenige Monate verabreicht (meist injiziert in den Bauchraum). So liest man in einem entsprechenden wissenschaftlichen Artikel: „Altern ist ein komplexes natürliches Phänomen, das durch degenerative Veränderungen in der Struktur und Funktion von Zellen und Geweben gekennzeichnet ist. D-Galactose-induzierte alternde Mäuse sind ein künstliches, beschleunigtes Alterungsmodell, das Gedächtnis- und Lernstörungen, oxidativen Stress und Neuroinflammation hervorruft.”[12] Diese tägliche Galactose-Zufuhr entspräche bei einem 70 kg schweren Menschen einer täglichen Menge von etwa 7 g Galactose (schon enthalten in 0,3 bis 0,6 Litern Milch; 3,5 g Milchzucker bzw. 1,75 g Galactose pro 100 ml). Dass diese Ergebnisse der Tierversuche sich zumindest tendenziell auf den Menschen übertragen lassen, wurde mittlerweile gezeigt: So steigt das Alzheimer-Risiko proportional zum (unnatürlichen) Milchkonsum von Menschen, die dem Säuglingsalter entwachsen sind.[13] Warum also, werden Sie sich fragen, empfiehlt man dann die Einnahme von Galactose, vor allem, wenn es darüber hinaus noch eine gesunde Alternative gibt?
Eine gesundheitsfördernde Alternative – kostengünstig und natürlich
Noch im Medizinstudium habe ich gelernt, dass Glucose die primäre Energiequelle unseres Gehirns sei. Doch das stimmt nicht, denn es gibt zum Zucker eine Alternative, um insbesondere unsere autobiografische Gedächtniszentrale – selbst bei schon bestehender hippocampaler Insulinresistenz – stetig mit Energie zu versorgen. Es handelt sich hierbei um sogenannte Ketonkörper. Diese haben sogar einen höheren Energiewert als Zucker (mehr Energiefreisetzung pro eingesetztem Sauerstoff) und entstehen beim Abbau bzw. Zerkleinern von gesättigten Fettsäuren in der Leber, nachdem diese durch das nächtliche Fasten aus den Fettspeichern mobilisiert wurden. Zu den Ketonkörpern zählt man das Acetoacetat (AcAc) und das D-β-Hydroxybutyrat (βOHB). Diese kleinen Moleküle überwinden, im Gegensatz zu lang- und mittelkettigen Fettsäuren, sehr effizient die Bluthirnschranke und benötigen auch kein Insulin, um in Nervenzellen zu gelangen und diese mit Energie zu versorgen. Schon in der frühen Kindheit, wenn in den langen Schlafphasen der „Babyspeck“ abgebaut wird, dienen die dabei entstehenden Ketonkörper der Energieversorgung des heranwachsenden Gehirns. Sie decken aber nicht nur einen großen Teil des Energiebedarfs des kindlichen Gehirns, sondern fördern aufgrund ihrer hormonellen Eigenschaften auch die Neurogenese und damit das Gehirnwachstum.[14]
Auch beim Erwachsenen sind Ketonkörper optimale Energielieferanten und aktivieren als hormonelle Signalgeber die adulte hippocampale Neurogenese.[15] Da sie auch den Abbau von funktionsgestörten überalterten Zellorganellen beschleunigen, sind sie für unser Gehirn ein wahrer Jungbrunnen. Für die Entdeckung des gesundheitsfördernden bzw. verjüngenden Effekts des Fastens wurde im Jahr 2016 der Medizinnobelpreis verliehen.[16] Mit ihren vielfältigen Funktionen sorgen die Ketonkörper bis ins höchste Alter für Wachstum, Verjüngung bzw. Regeneration[17] und Energieversorgung[18] des Hippocampus und sind daher eine natürliche Waffe gegen Alzheimer, wie der tabellarische Vergleich mit Zucker (aus meinem Buch „Das erschöpfte Gehirn”, S. 217) zeigt.
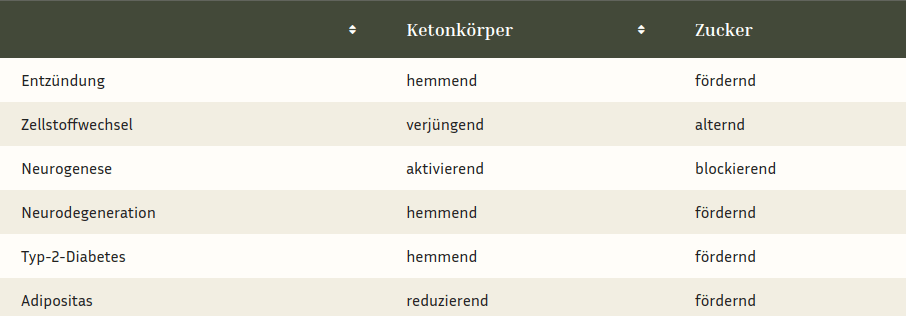
Wie die Tabelle zeigt, signalisieren hohe Ketonkörper-Spiegel dem Hippocampus, dass er wachsen soll. Zudem aktivieren sie nervenzellschützende Immunzellen.[19] Erhöhte Blutzuckerspiegel hingegen führen zu Entzündungen, die das Hirnwachstum hemmen und unsere Nervenzellen schneller altern lassen. Ketonkörper hingegen verjüngen unser Gehirn, indem sie den Zellstoffwechsel verbessern und so den Müllabbau in unseren Zellen aktivieren.
Fasten ist somit gesund, weil Ketonkörper gesund sind und uns vor vielen (modernen zivilisatorischen) Krankheiten schützen. Und Fasten kann ganz einfach sein, denn schon nach etwa 12 Stunden Zuckerpause ersetzen Ketonkörper immer mehr Glucose bzw. den Blutzucker als primäre Energiequelle für unser Gehirn (siehe unten). Dieser Zeitraum entspricht in etwa unserem nächtlichen Schlaf (plus Nahrungssuche in prähistorischen Zeiten) und ist somit die natürlichste Form des Fastens. Im Englischen wird dies auch durch das Wort für Frühstück ausgedrückt: Breakfast bedeutet wörtlich „Fasten-Brechen“. Doch sobald wir Zucker in Form von Brot, Pasta, Süßigkeiten oder Süßgetränken zu uns nehmen, wird durch die Blutzuckererhöhung und die nachfolgende Ausschüttung von Insulin die Freisetzung von Fettsäuren aus dem Fettgewebe blockiert und somit auch die während des Fastens
in der Leber stattfindende Ketogenese beendet. Der evolutionäre Vorteil dieser hormonellen Wirkungen könnte darin zu sehen sein, dass ein Organismus nach ein paar Stunden des Fastens in der Regel das Bedürfnis hat, auf Nahrungssuche zu gehen. Dadurch erlebt er Neues, was ein Hippocampus mit aktiver Neurogenese aktiv ist besser speichern und verarbeiten kann.
Ketonkörper können von der Leber in Mengen von bis zu 150 g/Tag aus mobilisierten Fettsäuren generiert werden (150 g entsprechen in etwa 1500 kcal).[20] Beim Menschen liegt der basale Serumspiegel beispielsweise von βOHB zwar im niedrigen mikromolaren Bereich, steigt aber nach 12 bis 16 Stunden Fasten auf mehrere Hundert Mikromol an. [21] Wichtig ist, dass bei niedrigem Blutzucker bis zu 60 Prozent des Energiebedarfs des Gehirns aus Ketonkörpern gewonnen werden kann, um Glucose als primären Brennstoff zu ersetzen.[22] So können Ketonkörper den Hippocampus selbst bei Insulinresistenz weiterhin mit Energie versorgen – und uns aufgrund der zuvor genannten hormonellen Eigenschaften vor Alzheimer (und dem Alzheimer-Toxin) schützen.[23] Nimmt man hingegen Zucker und insbesondere nicht durch Insulin regulierte Galactose zu sich, bewirkt dies genau das Gegenteil.
Ketonkörper können aber auch nach Beendigung des Fastens weiterhin effizient produziert werden, selbst wenn wir keine langkettigen gesättigte Fettsäuren aus unseren Fettdepots mobilisieren. Der Trick liegt in der Zufuhr von natürlichen mittelkettigen Fettsäuren über die Nahrung. Diese werden im Gegensatz zu langkettigen Fettsäuren über die sogenannte Pfortader nach der Resorption im Darm direkt in die Leber transportiert und dort zu Ketonkörpern verstoffwechselt. Mittelkettige Fettsäuren kommen in der Natur in höheren Mengen nahezu ausschließlich in Palmfrüchten wie der Kokosnuss und in der Milch einiger Säugetierarten vor. So weist die menschliche Muttermilch mit etwa zehn Prozent eine besonders hohe Konzentration an mittelkettigen Fettsäuren auf.[24] Fettsäuren, die während der Stillzeit von der Brustdrüse gezielt hergestellt werden, fördern die kindliche Hirnentwicklung.[25] Dies war aus evolutionsbiologischer Sicht mit entscheidend für die enorme Gehirnentwicklung des Menschen.[26] Kokosöl extendiert auf ganz natürliche Weise den Hirnwachstums- und Regenerationseffekt auf das gesamte restliche Leben und schützt somit sogar vor Alzheimer.[27] Falls Sie an dieser Stelle etwas unsicher oder nervös geworden sein sollten, weil die Industrie Ihnen erklärt hat, dass gesättigte Fettsäuren ungesund seien, dann empfehle ich meinen Artikel „Kokosöl sei reines Gift ─ eine wissenschaftliche Gegendarstellung”.
Es gibt also keinen Bedarf an gehirnschädlicher Galactose, dafür jedoch mit vom Körper selbst produzierten Ketonkörpern einen Energielieferanten mit hormoneller Schutzfunktion vor Alterungsprozessen und Alzheimer, der unsere Gedächtniszentrale nicht nur rund um die Uhr, sondern auch enorm kostengünstig mit Energie versorgen kann, wie folgende Rechnung zeigt: Um ein beschleunigtes Altern hervorzurufen, erhalten Mäuse und Ratten täglich etwa 100 Milligramm (mg) Galactose pro kg Körpergewicht, meist nur über wenige Monate hinweg.[28] Das entspricht, hochgerechnet auf einen erwachsenen Menschen von 70 kg Körpergewicht, in etwa 7 g Galactose pro Tag. Diese schädliche Menge ist sogar noch weniger als die 10 bis 12 g Galactose, die beispielsweise ein Artikel in Natur&Heilen vom April 2023 zur Einnahme bei Alzheimer empfiehlt.[29] 12 g Galactose pro Tag (etwa 48 kcal) kosten beispielsweise bei der Firma Falcento etwa € 3 (€ 62,50 für 250 g; es gibt auch um Faktor 2 bis drei günstigere Quellen, dennoch bleiben die genannten Probleme).[30] Die Kosten für die in dem Artikel empfohlene Jahresdosis lägen somit bei etwas über € 1000. Dieselbe kalorische Menge an ketogenen mittelkettigen Fettsäuren aus Kokosöl (5,5 g mittelkettige Fettsäuren mit etwa 9,1 kcal/g in etwa 10 g Kokosöl, also ebenso etwa 50 kcal) kostet jedoch nur etwa 10 Cent, und die bekommt man sogar in Bioqualität. Bei einer Jahresdosis für nur etwa € 35 ist gesundes Kokosöl somit um einiges günstiger als ungesunde Galactose. Ich empfehle bei hippocampaler Insulinresistenz allerdings bis zu etwa 50 g Kokosöl pro Tag, als Butterersatz zum Backen, Braten oder als Brotaufstrich (siehe mein Buch „Kopfküche”), womit man mit etwa 450 kcal schon fast ein Viertel seines gesamten Grundenergiebedarfs mit etwa 50 Cent pro Tag abdeckt. Günstiger geht gesunde Ernährung wohl kaum.
Zusammenfassung
Der Gedanke, eine gestörte Aufnahme von Glucose infolge einer hippocampalen Insulinresistenz bei Alzheimer dadurch zu überwinden, dass man Galactose verabreicht, ist wissenschaftlich nicht nachzuvollziehen. Galactose ist für diesen Zweck als Ersatz für Glucose nicht geeignet, im Gegenteil, wie tierexperimentell gezeigt. Als natürlicher Ersatz eignen sich nur Ketonkörper, vom Körper selbst produziert aus langkettigen Fettsäuren während des nächtlichen Fastens und aus mittelkettigen Fettsäuren, wie man sie in Kokosöl findet, während des Nichtfastens. Gegenüber Galactose, die entzündungsfördernd und damit gesundheitsschädlich ist, haben Ketonkörper neben einer natürlichen Energieversorgung noch die zusätzliche Eigenschaft, die Bildung neuer Hirnzellen anzuregen und Nervenzellen zu verjüngen. Der natürliche Weg, eine hippocampale Insulinresistenz zu umgehen und die autobiografische Gedächtniszentrale mit Energie zu versorgen, ist die Produktion von Ketonkörpern durch nächtliches Fasten, durch eine Vermeidung von Nahrungsmitteln, die den Blutzucker in die Höhe treiben und durch die Verwendung von vergleichsweise kostengünstigem Kokosöl.
Quellen:
[1] de la Monte SM: Type 3 diabetes is sporadic Alzheimer׳s disease: mini-review. Eur Neuropsychopharmacol 2014, 24:1954-1960, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4444430/
[2] Marcus C et al: Brain PET in the diagnosis of Alzheimer’s disease. Clin Nucl Med 2014, 39:413-426, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4332800/
[3] Michailidis M et al: Alzheimer’s Disease as Type 3 Diabetes: Common Pathophysiological Mechanisms between Alzheimer’s Disease and Type 2 Diabetes. Int J Mol Sci. 2022, https://www.ncbi.nlm.nih.gov/pmc/articles/pmid/35269827/
[4] Planchez B et al: Increasing Adult Hippocampal Neurogenesis Promotes Resilience in a Mouse Model of Depression. Cells 2021, https://pubmed.ncbi.nlm.nih.gov/33919292/; Hill AS et al: Increasing Adult Hippocampal Neurogenesis is Sufficient to Reduce Anxiety and Depression-Like Behaviors. Neuropsychopharmacology 2015, 40: 2368-2378, https://www.nature.com/articles/npp201585
[5] Nehls M: Unified theory of Alzheimer’s disease (UTAD): implications for prevention and curative therapy. J Mol Psychiatry 2016, https://www.ncbi.nlm.nih.gov/pmc/articles/pmid/27429752/
[6] Thomas R et al: Exercise Training Results in Lower Amyloid Plaque Load and Greater Cognitive Function in an Intensity Dependent Manner in the Tg2576 Mouse Model of Alzheimer’s Disease. Brain Sci 2020, https://pubmed.ncbi.nlm.nih.gov/32046299/; He XF et al: Voluntary Exercise Promotes Glymphatic Clearance of Amyloid Beta and Reduces the Activation of Astrocytes and Microglia in Aged Mice. Front Mol Neurosci 2017, https://pubmed.ncbi.nlm.nih.gov/28579942/; https://www.nih.gov/news-events/nih-research-matters/sleep-deprivation-increases-alzheimers-protein (24.04.2018); Reddy OC & van der Werf YD: The Sleeping Brain: Harnessing the Power of the Glymphatic System through Lifestyle Choices. Brain Sci 2020, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7698404/
[7] Storhaug CL et al: Country, regional, and global estimates for lactose malabsorption in adults: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol 2017, 2:738-746, https://pubmed.ncbi.nlm.nih.gov/28690131/
[8] Bo-Htay C et al: Effects of d-galactose-induced ageing on the heart and its potential interventions. J Cell Mol Med 2018, 22:1392-1410, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5824366/
[9] Kenawy S et al: Involvement of insulin resistance in D-galactose-induced age-related dementia in rats: Protective role of metformin and saxagliptin. PLoS One 2017, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5568415/
[10] Zhang Q et al: D-galactose injured neurogenesis in the hippocampus of adult mice. Neurol Res 2005, 27:552-556, https://pubmed.ncbi.nlm.nih.gov/15978184/; Cui X et al: Chronic systemic D-galactose exposure induces memory loss, neurodegeneration, and oxidative damage in mice: protective effects of R-alpha-lipoic acid. J Neurosci Res 2006, 83:1584-1590, https://pubmed.ncbi.nlm.nih.gov/16555301/
[11] Gao J et al: Salidroside suppresses inflammation in a D-galactose-induced rat model of Alzheimer’s disease via SIRT1/NF-κB pathway. Metab Brain Dis 2016, 31:771-778, https://pubmed.ncbi.nlm.nih.gov/26909502/; Li L et al: Moderate exercise prevents neurodegeneration in D-galactose-induced aging mice. Neural Regen Res 2016, 11:807-815, https://pubmed.ncbi.nlm.nih.gov/27335566/
[12] Li H, Zheng L, Chen C, Liu X, Zhang W. Brain Senescence Caused by Elevated Levels of Reactive Metabolite Methylglyoxal on D-Galactose-Induced Aging Mice. Front Neurosci 2019, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6760031/
[13] Gu Y et al: Food combination and Alzheimer disease risk: a protective diet. Arch Neurol 2010, 67:699-706, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3029147/
[14] Cotter DG et al: Obligate role for ketone body oxidation in neonatal metabolic homeostasis. J Biol Chem 2011, 286:6902-6910, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3044945/
[15] Robinson AM & Williamson DH: Physiological roles of ketone bodies as substrates and signals in mammalian tissues. Physiol Rev 1980,60:143-87, https://journals.physiology.org/doi/abs/10.1152/physrev.1980.60.1.143
[16] https://www.tz.de/leben/gesundheit/medizin-nobelpreis-zellforscher-yoshinori-ohsumi-erklaert-gesunde-ernaehrung-6806197.html (3.10.2016)
[17] Mattson MP et al: Intermittent metabolic switching, neuroplasticity and brain health. Nat Rev Neurosci 2018, 19:63-80, https://www.ncbi.nlm.nih.gov/pmc/articles/pmid/29321682/
[18] Maffezzini C et al: Metabolic regulation of neurodifferentiation in the adult brain. Cell Mol Life Sci 2020, 77:2483-2496, https://www.ncbi.nlm.nih.gov/pmc/articles/pmid/31912194/
[19] Gano LB et al: Ketogenic diets, mitochondria, and neurological diseases. J Lipid Res 2014, 55:2211-2228, https://www.ncbi.nlm.nih.gov/pmc/articles/pmid/24847102/
[20] Newman JC & Verdin E: Ketone bodies as signaling metabolites. Trends Endocrinol Metab 2014, 25:42-52, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4176946/
[21] Robinson AM & Williamson DH: Physiological roles of ketone bodies as substrates and signals in mammalian tissues. Physiol Rev 1980,60:143-87, https://journals.physiology.org/doi/abs/10.1152/physrev.1980.60.1.143
[22] Owen OE et al: Brain metabolism during fasting. J Clin Invest 1967, 46:1589-1595, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC292907/
[23] Hertz L et al: Effects of ketone bodies in Alzheimer’s disease in relation to neural hypometabolism, β-amyloid toxicity, and astrocyte function. J Neurochem 2015, 134:7-20, https://pubmed.ncbi.nlm.nih.gov/25832906/
[24] Hilditch TP & Meara ML: Human-milk fat: 1. Component fatty acids. Biochem J 1944, 38:29-34; Mazzocchi A et al: The Role of Lipids in Human Milk and Infant Formulae. Nutrients 2018, www.ncbi.nlm.nih.gov/pmc/articles/PMC5986447
[25] Hachey, DL et al.: „Human lactation. II: Endogenous fatty acid synthesis by the mammary gland“, Pediatr Res 1989, 25:63–68
[26] Cunnane, SC & Crawford, MA: „Energetic and nutritional constraints on infant brain development: implications for brain expansion during human evolution“, J Hum Evol 2014, 77:88–98
[27] Taylor, MK et al.: „Dietary Neuroketotherapeutics for Alzheimer’s Disease: An Evidence Update and the Potential Role for Diet Quality“, Nutrients 2019, www.ncbi.nlm.nih.gov/pmc/articles/PMC6722814
[28] Jung WK et al: Advanced Glycation End Products Increase Salivary Gland Hypofunction in d-Galactose-Induced Aging Rats and Its Prevention by Physical Exercise. Curr Issues Mol Biol. 2021, 43:2059-2067, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8928989/
[29] Westphal-Lanzenberger L: Galaktose: Intelligenter Zucker gegen Alzheimer und Insulinresistenz. 2023. 4:23-29
[30] https://shop.mosetter.de/ (zuletzt abgerufen am 7.07.2023)

